
А.Ф. Цыб,

В.К. Иванов
Медицинский радиологический научный центр РАМН
(Национальный радиационно-эпидемиологический регистр), Обнинск
|
А.Ф. Цыб, |
В.К. Иванов |
В 1986 году после чернобыльской катастрофы в бывшем СССР был создан Всесоюзный распределенный регистр лиц, подвергшихся радиационному воздействию. После распада СССР в России в 1992 году начал функционировать Российский государственный медико-дозиметрический регистр (РГМДР). При ведении регистра особое внимание уделяется наблюдением за состоянием здоровья ликвидаторов последствий чернобыльской аварии, которые получили максимальные дозовые нагрузки (средняя доза 0.11 Гр).
Известно, что среди радиогенных злокачественных новообразований лейкемия имеет максимальный радиационный риск и минимальный латентный период 2 года. Поэтому превышение заболеваемости лейкозами над спонтанным уровнем может служить первым индикатором воздействия облучения на здоровье облученных людей после чернобыльской аварии.
Основным источником информации о зависимости доза-эффект для лейкозов являются данные о переживших атомную бомбардировку в Японии (Preston D. et al., 1994). Эти данные получены в основном в области средних и высоких доз (>0.2 Гр) и в условиях острого облучения. Однако результаты исследований в области малых доз и мощностей дозы немногочисленны, так как для таких исследований требуются когорты с большой численностью и длительным периодом наблюдения. Среди исследований в области малых доз и мощностей дозы необходимо отметить объединенное исследование заболеваемости лейкозами среди работников атомной промышленности (Preston D. et al., 1994) нескольких стран, в котором были получены статистически значимые радиационные риски лейкозов для условий пролонгированного облучения и уровня накопленных радиационных доз (менее 0.1 Гр). Поэтому когорта ликвидаторов в этом смысле может представлять интерес для получения новой информации о дозовой зависимости в области доз меньше 0.2 Гр.
Впервые анализ радиационных рисков заболеваемости лейкозами в когорте ликвидаторов из России был сделан в 1996 году. Результаты анализа опубликованы в (Cardis E. et al., 1995; Ivanov V.K. et al., 1997a). В работе (Cardis E. et al., 1995) использован когортный метод исследования с выбором в качестве контрольной группы населения России соответствующего пола и возрастной структуры. В анализе была использована информация на 48 случаев заболеваний лейкозами, выявленных за период с 1986 по 1993 годы среди лиц мужского пола. Получено статистически значимое превышение заболеваемости лейкозами среди ликвидаторов над контролем. В предположении, что это превышение обусловлено воздействием облучения, была сделана оценка радиационных рисков заболеваемости лейкозами. Значение избыточного относительного риска при дозе 1 Гр равнялось 4.3 (0.8, 7.8 95% доверительные интервалы(ДИ)).
В работе (Ivanov V.K. et al., 1997b) использовался метод случай-контроль. Исследование не выявило статистически значимых рисков, однако, был показан положительный тренд в зависимости относительного риска от дозы.
Данная работа является продолжением исследований по анализу заболеваемости лейкозами среди ликвидаторов. За период с 1993 по 1997 год в распределении случаев лейкозов произошли существенные изменения: добавились новые случаи, зафиксированные как в данный период, так и выявленные ранее, уточнены диагнозы и даты их установления. Выявленное к настоящему моменту количество лейкозов позволяет провести анализ с использованием наиболее надежных медико-дозиметрических данных. Как показала практика функционирования РГМДР, информация, поставляемая региональными центрами, неоднородна по качеству. В данном исследовании использованы медико-дозиметрические данные для лиц мужского пола из шести экономических регионов России: Северо-Западного, Волго-Вятского, Поволжского, Центрально-Черноземного, Северо-Кавказского и Уральского. Данные, поставляемые этими регионами, характеризуются достаточной надежностью (устойчивостью основных показателей здоровья ликвидаторов) и высоким процентом прохождения ликвидаторами ежегодных диспансеризаций (около 86%).
1. Общее описание рассматриваемой когорты ликвидаторов
Полная численность рассматриваемой когорты (на 31.12.1997 года) составила 71217 человек. Это ликвидаторы, которые прошли хотя бы один раз диспансеризацию в рассматриваемый период, с документально подтвержденными дозами. В анализе использована индивидуальная информация о дате рождения, дате приезда в зону работ, дате отъезда из зоны работ, дате последнего осмотра, дате диагноза (для случаев заболеваний) и документально подтвержденной дозе.
Число человеко-лет наблюдения за период с 1986 по 1997 год равно 743845. Время под риском для каждого ликвидатора определялось как разница даты последнего осмотра (или диагноза для случаев заболеваний) и даты въезда в зону работ.
Потеря человеко-лет наблюдения не превышает 14% (отношение наблюдаемого количества человеко-лет к теоретическому количеству при 100% явке на ежегодную диспансеризацию равно 86%).
На рисунке 1 представлена динамика человеко-лет наблюдения за когортой ликвидаторов. Подъем кривой в начальный период наблюдения обусловлен динамикой прибытия ликвидаторов зону работ, последующий спад - в основном процессом уменьшения численности когорты за счет смертности. Интенсивное уменьшение численности когорты к концу периода наблюдения объясняется 2-3-летним запаздыванием в процессе накопления и верификации данных. По этой причине анализируемый период наблюдения за когортой ликвидаторов был ограничен 1997 годом.
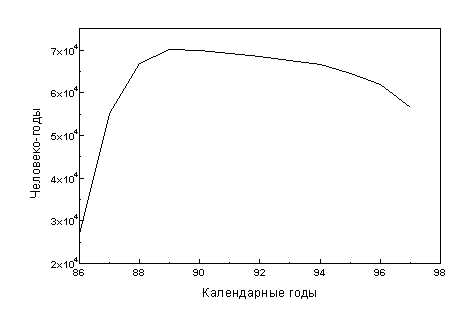
Рисунок 1. Динамика количества человеко-лет наблюдения для когорты ликвидаторов.
По основным дозиметрическим и демографическим характеристикам рассматриваемая когорта практически совпадает с когортой ликвидаторов в целом (всего в РГМДР на 01.01.1999 г. зарегистрировано 174916 ликвидаторов). Подробное описание всей когорты приведено, например, в (Ivanov V.K. et al., 1997a).
На рисунке 2 представлена функция распределения численности ликвидаторов по возрасту при облучении. Средний возраст на момент въезда в зону работ вокруг Чернобыльской АЭС равнялся 34.7 года для здоровых персон и 32.4 для ликвидаторов с выявленными случаями заболеваний. Из рисунка 2 видно, что заболевшие лица имеют меньший средний возраст при облучении, чем здоровые.
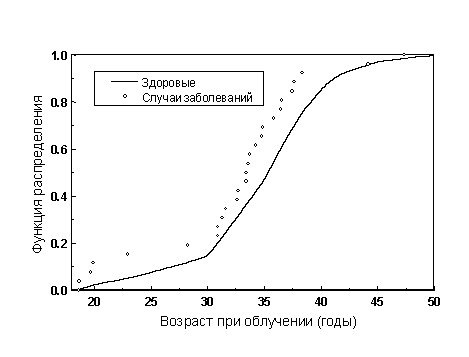
Рисунок 2. Функция распределения ликвидаторов по возрасту при облучении.
Всего за рассматриваемый период времени (1986-1997 гг.) в рассматриваемых регионах выявлено 44 случая лейкозов (31 случай заболевания лейкемией среди ликвидаторов с установленной дозой). Случаи, которые к моменту анализа были не полностью верифицированы, не рассматривались. Четыре случая заболеваний диагностированы во время латентного периода 2 года и из исследования исключены. Таким образом, в анализе дозовой зависимости рассмотрены 27 случаев заболеваний. Динамика заболеваний представлена в таблице 1.
Структура заболеваемости приведена в таблице 2. В соответствии с таблицей 2 острые лейкозы составляют 39% от общего количества.
Таблица 1
|
Календарный год |
1986 |
1987 |
1988 |
1989 |
1990 |
1991 |
1992 |
1993 |
1994 |
1995 |
1996 |
1997 |
|
Число |
0 |
0 |
3 |
1 |
4 |
3 |
3 |
2 |
6 |
4 |
3 |
2 |
Таблица 2
|
Форма лейкоза (код МКБ 9) |
Число случаев | |
|
Абсолютное |
% | |
|
Все острые лейкозы |
12 |
39 |
|
Острый лимфолейкоз (204.0) |
2 |
7 |
|
Острый миелоидный лейкоз (205.0) |
6 |
19 |
|
Другие острые лейкозы(206.0-208.0) |
4 |
13 |
|
Все хронические лейкозы |
19 |
61 |
|
Хронический лимфолейкоз (204.1) |
8 |
26 |
|
Хронический миелоидный лейкоз (205.1) |
11 |
35 |
|
Другие миелоидные лейкозы |
0 |
0 |
|
Всего (204-208) |
31 |
100 |
Все случаи, вошедшие в исследование, были верифицированы согласно принятому в РГМДР алгоритму. Процесс верификации диагнозов «лейкоз» проходил на 2 уровнях, то есть по месту жительства и на уровне РГМДР. Результаты верификации диагноза по месту жительства высылались в РГМДР, где эксперт-медик, специалист в области диагностики гемобластозов, проводил окончательную верификацию диагноза. В пакет документов, представленных на экспертизу в РГМДР, входили первичные медицинские документы, такие как выписки из амбулаторных карт, истории болезни, заключение гематолога, протоколы патологоанатомического вскрытия, в случае необходимости - диагностические материалы (мазки крови и костного мозга).
2. Дозиметрические характеристики когорты
По степени надежности дозиметрические данные для ликвидаторов можно разделить на три основные группы в зависимости от использованного метода оценки доз:
Дозовая нагрузка на ликвидаторов неоднородна и зависела от времени работ в зоне облучения. Средние дозы максимальны для ликвидаторов, работавших в 1986 году. В таблице 3 приведены средние дозы, время пребывания в зоне работ и мощность дозы, полученная делением индивидуальной дозы на время пребывания.
Таблица 3
|
Год работ |
Численность |
Средняя доза (Гр)* |
Средняя длительность |
Средняя мощность дозы (мГр/сутки)* |
|
1986 |
26867 |
0.17 |
78.3 |
4.3 |
|
1987 |
28845 |
0.09 |
82.8 |
1.6 |
|
1988 |
11918 |
0.03 |
111.6 |
0.5 |
|
1989 |
3736 |
0.03 |
107.3 |
0.5 |
|
1990 |
451 |
0.04 |
109.8 |
0.5 |
|
1986-1990 |
71817 |
0.11 |
87.4 |
2.3 |
* - Усреднение производилось с весом количества человеко-лет наблюдения.
На рисунке 3 приведено распределение ликвидаторов по дозе внешнего облучения. Как следует из рисунка, распределения отличны друг от друга и средняя доза среди случаев заболеваний больше дозы среди здоровых, что в определенной степени может указывать на наличие эффекта облучения.
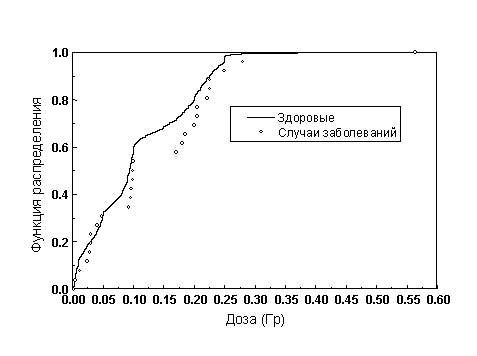
Рисунок 3. Распределение численности ликвидаторов по дозе внешнего облучения.
Распределение ликвидаторов по длительности пребывания и мощности дозы иллюстрируют рисунки 4, 5. Видно, что у половины ликвидаторов мощность дозы не превышает 2 мЗв/день.
Основные характеристики когорты ликвидаторов приведены в таблице 4.
Рисунок 4. Плотность распределения
численности ликвидаторов по длительности пребывания
в зоне облучения
(дни).
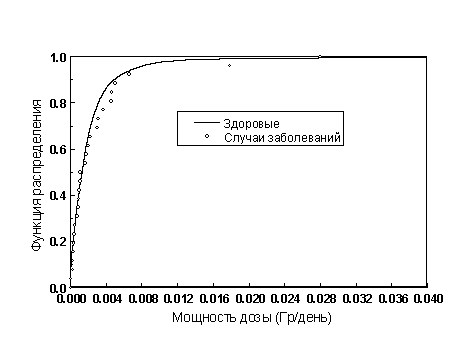
Рисунок 5. Распределение ликвидаторов по мощности дозы.
Таблица 4
|
Статус |
Случаи заболеваний лейкозами, использованные для оценки
|
Случаи заболеваний лейкозами использованные для оценки
|
Здоровые |
|
Общее количество |
27 |
21 |
71217 |
|
Средняя доза (Гр) |
0.135 |
0.153 |
0.108 |
|
Средняя мощность дозы (Гр/день) |
0.0037 |
0.0042 |
0.0023 |
|
Среднее время пребывания в зоне работ (сутки) |
77.1 |
77.7 |
87.4 |
* - Случаи заболеваний с определенной дозой, для рассматриваемого периода наблюдения и выявленные после латентного периода 2 года.
Для оценки коэффициентов риска использован метод максимального правдоподобия в предположении, что случаи заболеваний являются независимыми пуассоновскими величинами. Критерии значимости определялись из асимптотических свойств отношений правдоподобия.
В анализе использована индивидуальная информация о дозе внешнего облучения, количестве человеко-лет наблюдения, показателе спонтанной заболеваемости.
По мнению авторов, использование индивидуальной информации при оценке рисков предпочтительно, с точки зрения минимизации влияния субъективного фактора и потери информации при группировке и стратификации данных.
Логарифм функции правдоподобия L для данной выборки:
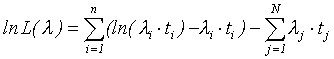 (1)
(1)
Где l - определяемый параметр (в данном случае показатель заболеваемости лейкозами); t- период времени наблюдения за членом когорты (для случая заболевания - период времени с начала наблюдения до постановки диагноза, для здорового члена когорты - период времени наблюдения за когортой); n- число случаев заболевания за период наблюдения; N- число здоровых членов когорты, рассмотренных в анализе за период наблюдения.
Доверительные интервалы для оцениваемых параметров определялись с использованием асимптотических свойств функции правдоподобия, из решения уравнения (Handbook of applicable mathematics, 1984):
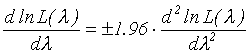 (2)
(2)
При оценке коэффициентов риска использованы линейная и линейно-квадратичная модели вида:
и ![]() .
(4)
.
(4)
Здесь: ![]() - средний за период наблюдения показатель спонтанной заболеваемости
лейкозами, соответствующий возрасту i-го члена когорты. Величина среднего
показателя определялась из уравнения:
- средний за период наблюдения показатель спонтанной заболеваемости
лейкозами, соответствующий возрасту i-го члена когорты. Величина среднего
показателя определялась из уравнения:
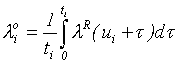 (5)
(5)
Где ![]() - возрастная зависимость показателя спонтанной заболеваемости;
ui - возраст при облучении для i-го члена когорты. В
качестве спонтанной заболеваемости использовалась возрастная зависимость
показателя для России в целом (Аксель Е., Двойрин В., 1992); di
- доза внешнего облучения для i-го члена когорты;
ERR1Гр - избыточный относительный риск на единицу дозы.
- возрастная зависимость показателя спонтанной заболеваемости;
ui - возраст при облучении для i-го члена когорты. В
качестве спонтанной заболеваемости использовалась возрастная зависимость
показателя для России в целом (Аксель Е., Двойрин В., 1992); di
- доза внешнего облучения для i-го члена когорты;
ERR1Гр - избыточный относительный риск на единицу дозы.
Так как величины доз внешнего облучения и мощности дозы относительно не велики, для оценки влияния мощности дозы на заболеваемость использована линейная модель, в предположении, что влияние этих факторов аддитивно:
Здесь dr - мощность дозы [Гр/день]-1; k - коэффициент, учитывающий отличие спонтанной заболеваемости в когорте ликвидаторов в рассматриваемый период от населения России соответствующего возраста. В рассматриваемой модели этот коэффициент равен стандартизованному отношению заболеваемости (SIR). Отличие коэффициента k от единицы может быть обусловлено разницей в системе регистрации заболеваний (например, ликвидаторы проходят регулярные медицинские обследования) и в уровне верификации диагнозов. В расчетах предполагалось, что этот коэффициент одинаков во всех возрастных группах. Таким образом, для определения риска используется только относительное возрастное распределение показателей спонтанной заболеваемости.
Временной тренд риска за рассмотренный период исследован в рамках линейной модели (6), с тем лишь отличием, что g и dr имели смысл изменения риска на единицу времени и времени после облучения соответственно.
Отношение ERR1Гр/a является оценкой коэффициента дозы и мощности дозы (DDREF) в рассматриваемом диапазоне доз (0~0.25 Гр).
Возникает вопрос о достоверности данных о возрастном распределении коэффициентов спонтанной заболеваемости. Разумно предположить, что распределение относительной заболеваемости лейкозами по возрасту достаточно консервативная величина и слабо зависит от географических и этнических признаков.
Для проверки данной гипотезы и анализа качества российских данных в рамках высказанной гипотезы воспользуемся возрастными функциями распределениями показателей заболеваемости лейкозами для крупнейших раковых регистров мира (Cancer Incidence in Five Continents, 1987). Функция распределения fj рассчитывалась из соотношения:
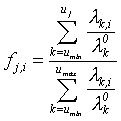 .
(7)
.
(7)
Где umax-umin - рассматриваемый
диапазон возраста; ![]() - возрастное распределение показателя заболеваемости в регистре,
выбранном в качестве контроля; i - индекс регистра.
- возрастное распределение показателя заболеваемости в регистре,
выбранном в качестве контроля; i - индекс регистра.
На рисунке 6 приведена функция распределения нормированных показателей заболеваемости по возрасту при диагнозе для регистров США (белые), Великобритании, Беларуси и России (Cancer Incidence in Five Continents, 1987). Распределение нормировано на возрастные показатели ракового регистра, выбранного в качестве контрольного (данные по России в целом). Функция распределения получена для мужчин, имеющих достигнутый возраст 20-70 лет.
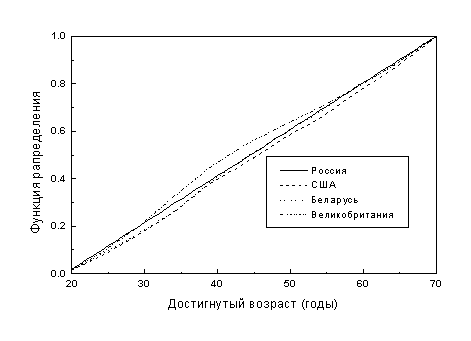
Рисунок 6. Функция распределения
заболеваемости лейкозами (мужчины)
по достигнутому возрасту для различных
стран.
Результаты, приведенные на рисунке 6, подтверждают предположение о близости относительных распределений возрастной заболеваемости лейкозами в различных странах и достаточную надежность этой характеристики российских данных, используемых в качестве контроля.
В данной работе проведено сравнение радиационных рисков, полученных для рассматриваемой когорты ликвидаторов, с рисками радиогенных лейкозов всех типов в когорте LSS (Life Span Study), переживших атомную бомбардировку в Японии (Preston D. et al., 1994). Для того чтобы сравнение было корректным (когорта LSS имеет другую возрастную структуру, другие показатели спонтанной заболеваемости), был применен следующий подход. В (Preston D. et al., 1994) опубликованы апроксиманты показателей спонтанной заболеваемости и превышающего абсолютного риска для всех лейкозов и отдельных типов для когорты LSS:
Лейкемия все типы (МКБ-9: 204-208) (использованы обозначения, приведенные в (Preston D. et al., 1994)).
где a - достигнутый возраст; g - возраст при облучении.
Избыточный абсолютный риск EAR(10-4 PY):
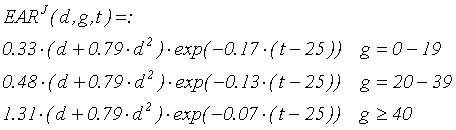
где d - доза (Зв); t - время после облучения.
Чтобы учесть отличие в спонтанных уровнях заболеваемости был сделан переход от апроксимант абсолютного риска к апроксимантам избыточного относительного риска через соотношение ERRJ(d,g,t)=EARJ(d,g,t)/lJ(g,g+t) (l - апроксиманта показателя спонтанной заболеваемости лейкозами в когорте LSS).
Так как лейкозы относятся к редким заболеваниям, с хорошей точностью число заболеваний лейкозами (С) можно описать выражением:
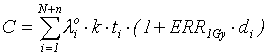 .
(8)
.
(8)
Суммирование ведется по всем членам рассматриваемой когорты с использованием определенных параметров модели (3).
Для данной когорты С=27, числу лейкозов, рассмотренных в анализе. Ожидаемое число лейкозов можно получить, если использовать апроксиманту риска ERRJ(di,gi,ti) из когорты LSS и индивидуальную информацию на каждого ликвидатора, определяется в соответствии с (8), с заменой избыточного относительного риска ERR на:
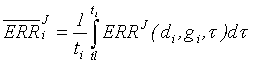 (9)
(9)
среднее значение риска на интервале наблюдения (tl - латентный период).
Тогда средний за рассматриваемый период избыточный относительный риск на единицу дозы для всей когорты определится в соответствии с выражением (8):
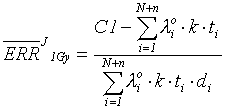 (10)
(10)
При оценке количества радиогенных лейкозов учитывался латентный период (2 года).
Исходя из опыта японских и других зарубежных исследований, свидетельствующих об отсутствии радиационной зависимости в отношении хронического лимфолейкоза (ХЛЛ) (Preston D. et al., 1994), в данной работе проведен анализ и с исключением таких случаев.
Результаты оценки параметров модели (3) представлены в таблице 5. Для лейкозов всех типов значения радиационного риска статистически не значимы (p=0.04), если рассматривать 95% ДИ. При исключении ХЛЛ риск становится статистически значимым и равен 11.7 (3.3, 20.1 95% ДИ) на 1 Гр (p<0.001). Значения SIR меньше единицы объясняются тем, что в анализе рассмотрены только верифицированные на момент анализа случаи лейкозов (на момент анализа в списке заболевших ликвидаторов находились еще 11 человек, диагноз лейкоза у которых требовал уточнения).
Результаты оценки риска индукции радиогенных лейкозов в когорте
ликвидаторов
(с использованием данных по спонтанной заболеваемости в
России)
|
Параметр |
Все лейкозы |
Все лейкозы, исключая ХЛЛ |
Все лейкозы |
|
ERR/Гр |
3.5 (-0.5, 7.5) |
11.7 (3.3, 20.1) |
10.2 (2.8, 17.4) |
|
Коэффициент k |
0.7 (0.4, 0.9) |
0.4 (0.2, 0.6) |
0.4 (0.2, 0.6) |
Риск радиогенных лейкозов становится статистически значим для всех типов лейкозов, если исключить из анализа ликвидаторов, которые были облучены в 1988-1990 годах и получили в среднем меньшие дозы, чем ликвидаторы, облученные в 1986-1987 годах.
Результаты расчетов по линейно-квадратичной модели (4) показывают, что в рассматриваемом диапазоне доз и мощностей доз влияние квадратичного члена несущественно (значение коэффициента при линейном члене 9.7 (1.69, 17.67)). Уровень значимости гипотезы линейности p=0.89. Значение фактора дозы и мощности дозы DDREF=11.7/9.7=1.2.
Параметры модели (6) показаны в таблице 6. Введение фактора мощности дозы практически не изменило значение избыточного относительного риска, что свидетельствует о слабом влиянии этого фактора на риск индукции радиогенных раков для рассматриваемого диапазона доз и мощностей доз. Уровень значимости гипотезы, что коэффициент риска не зависит от мощности дозы p=0.79. Величина коэффициента чувствительности риска к мощности дозы статистически незначима.
С использованием этой же модели сделана оценка временного тренда избыточного относительного риска в рассматриваемый промежуток времени. Расчеты показывают, что избыточный относительный риск уменьшается во времени (уровень значимости гипотезы, что тренд отсутствует p=0.02).
Таблица 6
|
Параметр |
Все лейкозы, исключая ХЛЛ (95% доверительные интервалы) |
|
ERR/Гр |
10.7 (2.2, 19.1) |
|
Риск на Гр/день |
43.7 (-213.4, 300.8) |
Как показано на рисунке 6, возрастные распределения заболеваемости по данным различных онкологических регистров близки, поэтому сделана оценка риска с показателями спонтанной заболеваемости для различных стран. Результаты расчетов приведены в таблице 7. Видно, что результаты оценок риска практически одинаковы, независимо от того, данные какого регистр были использованы в расчетах. Спонтанная заболеваемость для рассматриваемого диапазона возрастов и пола близка.
Таблица 7
|
Регистр |
Россия |
США |
Беларусь |
Великобритания |
|
ERR/Гр |
3.5 (-0.5, 7.5) |
3.6 (-0.5, 7.7) |
3.7 (-0.4, 7.8) |
3.8 (-0.4, 8.0) |
|
Коэффициент k |
0.7 (0.4, 0.9) |
0.5 (0.3, 0.7) |
0.5 (0.3, 0.7) |
0.7 (0.4, 1.0) |
Полученный результат интересен тем, что показана принципиальная возможность использования данных о заболеваемости, хранящихся в регистрах, имеющих отлаженную систему сбора и верификации и большой объем онкологической информации. Этот результат может быть полезен при анализе данных, полученных для небольших популяций, для таких редких заболеваний как лейкозы.
С использованием апроксимант, полученных в когорте LSS, сделана оценка среднего за рассматриваемый период избыточного относительного риска на единицу дозы для всех типов лейкозов. Аналогичным способом была рассчитана динамика избыточного риска для когорты ликвидаторов во времени (рисунок 7). Избыточный относительный риск на 1 Гр равен 12.1 и отличается от значения 3.5, рассчитанного с рассматриваемым набором данных. Ожидаемое кумулятивное число случаев при использовании японских коэффициентов риска равно С1=45.6 (наблюдаемое значение 27 случаев). Однако, если учесть, что в когорте LSS практически отсутствуют заболевания ХЛЛ (Preston D. et al., 1994), то значение 12.1 хорошо согласуется со значением 11.7, полученным в когорте ликвидаторов при исключении этого типа лейкозов.
Как следует из рисунка 7, за рассматриваемый интервал времени избыточный относительный риск уменьшается. За весь период риск уменьшился в 4 раза.
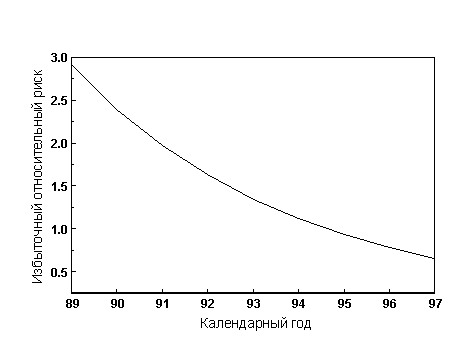
Рисунок 7. Избыточный относительный риск в
когорте ликвидаторов как функция времени
после аварии (для оценки динамики
использованы апроксиманты (Preston D. et al., 1994)).
Данная работа является логическим продолжением исследований в России заболеваемости лейкозами среди ликвидаторов (Ivanov V.K. et al., 1997a; Ivanov V.K. et al., 1997b). Актуальность этой темы очевидна, так как ликвидаторы получили в среднем более высокие, чем население загрязненных регионов, дозы ионизирующего излучения и радиогенные лейкозы являются первым индикатором проявления отдаленных последствий облучения. Исследование (Ivanov V.K. et al., 1997a) проведено для всей когорты ликвидаторов с использованием внешнего контроля - соответствующей возрастной категории населения России. Известно, что использование внешнего контроля может привести к смещению оценок риска, вследствие отличий в системе сбора, регистрации и верификации диагнозов в исследуемой и референтной группах. Оценка риска в (Ivanov V.K. et al., 1997a) была сделана при осторожном предположении, что превышение наблюдаемой заболеваемости над контролем может быть обусловлено радиационным фактором. Таким образом, основной целью работы (Ivanov V.K. et al., 1997a) была не оценка рисков лейкозов, а обозначение существующих тенденций в заболеваемости лейкозами в когорте ликвидаторов и привлечение интереса исследователей к этой теме.
В работе (Ivanov V.K. et al., 1997b) для анализа рисков использован подход «случай-контроль». Анализ не выявил статистически значимых рисков, был установлен только положительный тренд заболеваемости лейкозами в зависимости от дозы внешнего облучения. Отсутствие значимых рисков в исследовании (Ivanov V.K. et al., 1997b) может быть обусловлено проблематичностью использования методологии случай-контроль для когорты ликвидаторов в условиях сравнительно небольшого количества прямых измерений доз и лимитирования максимально допустимых доз.
Информация о когорте ликвидаторов, использованная в представленном анализе, является наиболее надежной. Использованы верифицированные данные РГМДР, отлажена система сбора и верификации информации (для стабильного функционирования такой большой динамической информационной системы как РГМДР с числом зарегистрированных лиц более 170 тысяч, потребовался определенный период). Для анализа применен подход, максимально использующий априорную информацию о заболеваемости лейкозами.
Полученные оценки риска радиогенных лейкозов всех типов, для всей когорты ликвидаторов статистически не значимы при выбранных доверительных интервалах 95%. По-видимому, это связано со сравнительно небольшим (27 случаев) количеством заболеваний, рассмотренных в анализе, и возможным смещением оценки из-за учета хронических лимфолейкозов, зависимость «доза-эффект» для которых не установлена. Исключение ХЛЛ из анализа увеличивает риск, и риск становится статистически значим. Этот результат подтверждает современную концепцию, что ХЛЛ не имеют выраженной дозовой зависимости.
Риск радиогенных лейкозов становится статистически значим для всех типов лейкозов, если исключить из анализа ликвидаторов, которые были облучены в 1988-1990 годах и получили в среднем меньшие дозы, чем ликвидаторы, облученные в 1986-1987 годах.
Рассмотренная модель риска, использующая априорную информацию о спонтанной заболеваемости, интересна тем, что позволяет использовать индивидуальную информацию и сразу оценить две основные характеристики: коэффициент риска и стандартизованное отношение заболеваемости - отличие заболеваемости в когорте от национального уровня (или от референтной группы). При этом показано, что для анализа рисков с хорошей точностью может быть использована информация других онкологических регистров, имеющих большой объем данных и отлаженные системы сбора и верификации лейкозов, например, регистров США, Великобритании. Полученный результат может быть полезен для анализа заболеваемости такими редкими заболеваниями как лейкозы в популяциях с небольшой численностью.
Использованный в анализе набор данных хорошо описывается линейной дозовой зависимостью, уровень значимости гипотезы линейности p=0.89. Вследствие чего значение фактора дозы и мощности дозы DDREF близко к единице.
В рассмотренном диапазоне доз (до 0.25 Гр) и мощностей дозы (до 0.01 Гр/день) влияние фактора мощности дозы на риск радиогенных раков статистически не значимо. Исследование проведено в рамках линейной модели. Данное приближение представляется оправданным, так как значения доз и мощностей доз, полученные ликвидаторами, сравнительно невелики.
Проведено сравнение рисков радиогенных лейкозов в когорте ликвидаторов с рисками для этой же когорты, рассчитанными с использованием апроксимант, полученных в когорте LSS. Апроксиманты риска являются функциями пола, возраста при облучении и времени после облучения, что позволяет провести корректное сравнение. Получено значение избыточного относительного риска на единицу дозы, равное 12.1. Так как количество ХЛЛ в когорте LSS мало (в силу географических и этнических особенностей когорты), приведенные в (Preston D. et al., 1994) апроксиманты для всех типов лейкозов фактически соответствуют риску, полученному с исключением ХЛЛ. Тогда представляется более правильным сравнивать значение риска 12.1 со значением риска равным 11.7, полученным в регрессионном анализе с исключением ХЛЛ.
Учитывая, что приведенные величины коэффициентов риска близки и временные тренды рисков имеют одинаковую тенденцию, можно утверждать, что модель риска, представленная в (Preston D. et al., 1994), достаточно адекватно описывает заболеваемость лейкозами в когорте ликвидаторов.
Полученное значение риска 11.7 (с исключением хронических лимфолейкозов) означает, что при средней дозе 0.1 Гр атрибутивный риск равен, примерно 50%, то есть половина из выявленных случаев заболеваний являются радиационно-обусловленными.
Результаты проведенного анализа дают основание утверждать, что дозовый фактор оказывает влияние на заболеваемость лейкозами среди ликвидаторов, живущих в России. Рост заболеваемости лейкозами среди ликвидаторов, по-видимому, является первым проявлением отдаленных последствий облучения населения после аварии на Чернобыльской АЭС.
Аксель Е., Двойрин В. Статистика злокачественных новообразований, ВОНЦ АМН СССР, М., 1992.
Cancer Incidence in Five Continents. D.M.Parkin et al. (Eds.), Vol. VI, IARC Scientific Publication, Lyon, 1987.
Cardis E., Gilbert E.S., Carpenter L., Howe G., Kato I., Armstrong B.K., Beral V., Cowper G., Douglas A., Fix J., Fry S.A., Kaldor J., Lave C., Salmon L., Smith P.G., Voelz G.L., Wiggs L.D. Effects of low doses and low doses rates of external ionizing radiation: Cancer mortality among nuclear workers in three countries. Radiat. Res. 1995, 143: 117-132.
Handbook of Applicable Mathematics. W.Ledermann (Ed.), Vol. VI “Statistics”, Part A, John Wiley&Sons Ltd, New York, 1984.
Ivanov V., Tsyb A., Gorsky A., Maksyutov M., Rastopchin E., Konogorov A., Korelo A., Biryukov A. Matyash V. Leukemia and thyroid cancer in emergency workers of the Chernobyl accident: estimation of radiation risks (1986-1995). Radiat. Environ. Biophys. 1997a, 36: 9-16.
Ivanov V.K., Tsyb A.F., Konogorov A.P., Rastopchin E.M., Khait S.E. Case-control analysis of leukaemia among Chernobyl accident emergency workers residing in the Russian Federation, 1986-1993. J. Radiol. Prot. 1997b, 17: 137-157.
Preston D., Kusumi S., Tomonaga M., Izumi S., Ron E., Kuramoto A., Kamada N., Dohy H., Matsuo T., Nonaka H., Thompson D., Soda M., Mabuchi K. Cancer incidence in atomic bomb survivors. Part III: Leukemia and multiple myeloma, 1950-1987. Radiat. Res. 1994, 137: S94.